Magazynowanie energii elektrycznej – zestaw metod umożliwiających przechowywanie energii elektrycznej na dużą skalę, w ramach sieci elektroenergetycznej. Energia może być magazynowana, gdy produkcja przeważa nad zużyciem i wykorzystywana, gdy zużycie przeważa nad produkcją. Dzięki temu produkcja energii z elektrowni nie musi być dostosowywana do chwilowego zużycia.
Ponieważ zapotrzebowanie na energię zmienia się w ciągu doby, magazynowanie energii umożliwia łatwiejsze i efektywniejsze wykorzystywanie elektrowni węglowych i jądrowych, poprzez ustalenie ich produkcji na stałym poziomie, bez potrzeby dostosowywania jej do chwilowego zapotrzebowania. Z drugiej strony, umożliwia masowe wykorzystywanie odnawialnych źródeł energii, takich jak energia wiatru i słoneczna, których dostępność ulega gwałtownym zmianom w ciągu doby. Bez magazynów energii, takie źródła muszą być wspomagane przez konwencjonalne elektrownie, które zaspokajają zapotrzebowanie, gdy odnawialne źródła produkują mniej energii.
Istnieją różne metody magazynowania energii. Do magazynowanie krótkoterminowego (najczęściej do kilku godzin) służą głównie:
- bateria akumulatorów małej pojemności,
- superkondensatory,
- akumulatory kinetyczne.
Z kolei w dłuższej perspektywie czasu energię magazynuje się za pomocą:
- elektrowni wodnych szczytowo-pompowych,
- dużych baterii akumulatorów,
- magazynowania sprężonego powietrza (ang. Compressed-Air Energy Storage – CAES),
- ogniw paliwowych.
Akumulatory – odwracalne ogniwa galwaniczne
Akumulatory to ogniwa, w których procesy są odwracalne i po zakończeniu procesu rozładowania wytworzone produkty można przy pomocy prądu elektrycznego ze źródła zewnętrznego z powrotem przeprowadzić w substraty i uzyskać ponownie źródło prądu. Ogniwa galwaniczne dzielimy na:
- ogniwa pierwszego rodzaju (pierwotne),
- ogniwa drugiego rodzaju (odwracalne),
- ogniwa paliwowe.
Ogniwa pierwszego rodzaju (pierwotne) działają jako źródło energii elektrycznej bez uprzedniego ładowania prądem z zewnętrznego źródła. Ogniwa drugiego rodzaju (odwracalne) to takie, w których procesy są odwracalne. Po zakończeniu procesu rozładowania, wytworzone produkty można, przy pomocy prądu elektrycznego ze źródła zewnętrznego, z powrotem przeprowadzić w substraty i uzyskać ponownie źródło prądu. Ogniwa paliwowe noszą w sobie cechy ogniw pierwotnych. Zasada ich działania polega na ciągłym dostarczaniu substratów w postaci paliwa podlegającego utlenianiu i jednocześnie na odprowadzaniu produktów utleniania. Typowym przykładem ogniwa paliwowego jest ogniwo wodorowo-tlenowe. Produktem reakcji jest woda. W ostatnim czasie pojawiły się ogniwa, w którym zachodzą procesy odwrotne (elektroliza wody oraz produkcja wodoru i tlenu). W tym przypadku (odwracalnych ogniw paliwowych) można mówić o ogniwach drugiego rodzaju.
Podstawowymi uwarunkowaniami praktycznego wykorzystywania chemicznych źródeł prądu są: łatwość eksploatacji i wytwarzania oraz zastosowanie łatwo dostępnych i niedrogich materiałów. Do samych oczekiwań stawianych ogniwom galwanicznym należą:
- długi czas życia,
- szeroki zakres temperatur pracy,
- odporność mechaniczna,
- wysoka wydajność energetyczna na jednostkę masy,
- duża sprawność
- małe samorozładowanie.
Obecnie najczęściej stosowanymi ogniwami są:
- akumulatory ołowiowo-kwasowe,
- zasadowe akumulatory niklowo-kadmowe i niklowo-wodorkowe,
- wysokotemperaturowe akumulatory sodowo-siarkowe,
- odwracalne ogniwa litowe.
Akumulatory ołowiowe
W pełni użyteczny, stosowany do tej pory akumulator ołowiowy (zwany kwasowym lub kwasowo-ołowiowym) skonstruował w 1859 roku francuski inżynier Gaston Plante. Akumulator ołowiowy zawiera:
- anodę wykonaną z ołowiu metalicznego,
- katodę wykonaną z dwutlenku ołowiu PbO2 osadzonym na ołowiu metalicznym,
- elektrolit w postaci wodnego roztworu kwasu siarkowego o stężeniu około 30%.
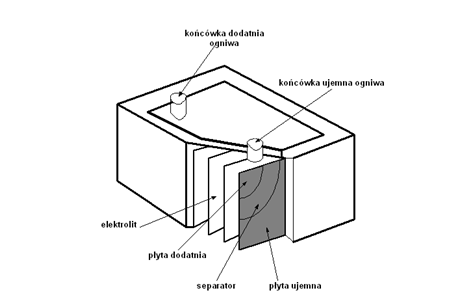
Rys. 1.1. Budowa akumulatora A. Czerwiński, Akumulatory, baterie, ogniwa, WKŁ, Warszawa 2005
Akumulator ołowiowy stanowi zestaw ogniw (baterię) połączonych ze sobą elektrycznie i zamkniętych w odseparowanych celach wewnątrz obudowy (bloku). W dwóch skrajnych ogniwach znajdują się wyprowadzenia, tzw. końcówki biegunowe, dodatnie i ujemne. Końcówki biegunowe są przeznaczone do połączenia akumulatora z obwodem elektrycznym, np. samochodu bądź falownika.
Obudowa akumulatora to blok z kwasoodpornego materiału, wewnątrz którego znajdują się zestawy płytowe, najczęściej z polipropylenu lub ebonitu.
Rozładowanie akumulatora to procesy chemiczne, w którym:
- na elektrodzie ujemnej następuje reakcja
Pb+SO42- Þ PbSO4+2e– (1)
- na elektrodzie dodatniej następuje reakcja
PbO2+4H+ + SO42- + 2e Þ PbSO4 + H2O (2)
Proces ten zobrazowano na rysunku 1.2.
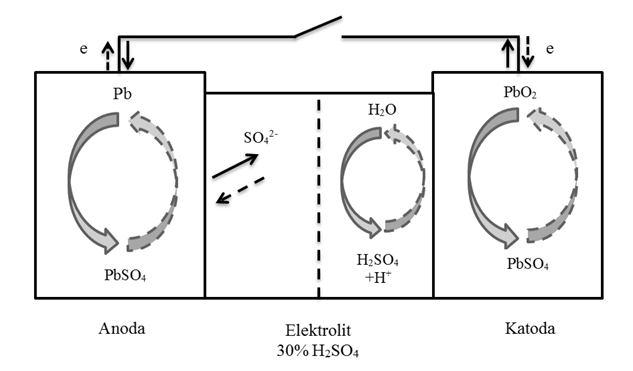
Rys. 1.2. Budowa chemiczna akumulatora
Źródło: opracowanie własne.
Napięcie ładowania i rozładowania akumulatora w funkcji czasu przedstawia natomiast rysunek 1.3.
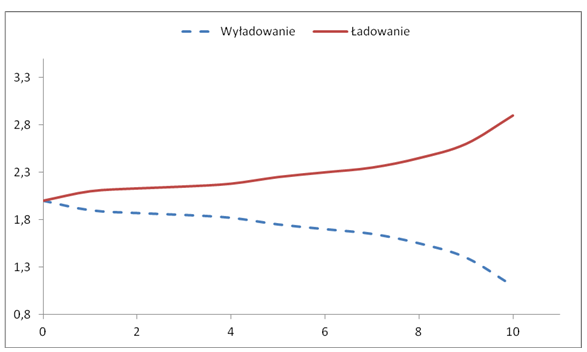
Rys. 1.3. Napięcie ładowania i rozładowania akumulatora w funkcji czasu Czerwiński A., Akumulatory, baterie, ogniwa., wyd. WKŁ, Warszawa 2005
W czasie rozładowywania akumulatora, zużywany jest kwas siarkowy, natomiast powstaje woda. Konsekwencją tego jest zmiana stężenia kwasu z 40% przy pełnym naładowaniu (dla pojedynczego ogniwa 2,15V) do 16% po rozładowaniu do napięcia 1,98V. Tak więc zmiana stężenia kwasu siarkowego jest miarą naładowania akumulatora. Na skutek formowania się na elektrodach warstwy siarczanu ołowiu, w czasie rozładowywania akumulatora wzrasta jego rezystancja wewnętrzna. Formowanie akumulatora dokonuje się przed przygotowaniem go do pracy. W praktyce jest to pierwsze ładowanie. Odbywa się ono pod całkowitą kontrolą, określonym prądem ładowania, w określonym czasie, w zależności od temperatury i typu elektrolitu. Długie pozostawienie akumulatora w stanie rozładowanym, eksploatacja w wysokich temperaturach, czy też zbyt wysokie stężenie kwasu siarkowego powodują wydzielane siarczanu ołowiu, który rekrystalizuje do formy gruboziarnistej. Proces ten nosi nazwę zasiarczania i powoduje zahamowanie procesu ładowania. Możliwa jest czasami regeneracja, poprzez ładowanie z elektrolitem o niewielkim stężeniu kwasu siarkowego, następnie usunięcie elektrolitu, dolanie wody destylowanej i ponowne wolne ładowanie, co prowadzi do przechodzenia osadzonego siarczanu do roztworu kwasu siarkowego. Po zakończeniu procesu regeneracji nie obserwuje się zmian gęstości elektrolitu. Aby zapobiec temu procesowi, skonstruowano akumulatory bezobsługowe MF (ang. Maintenace Free). Akumulatory te mogą być używany bez uzupełniania elektrolitu wodą przez 2–5 lat. W chwili obecnej około 80% sprzedawanych akumulatorów ołowiowych stanową akumulatory bezobsługowe. W akumulatorach tych elektrolit jest „unieruchomiony” w postaci żelu uformowanego przez dodanie krzemianów lub siarczanu wapnia. Baterie są szczelne, wyposażone w jednokierunkowy wentyl bezpieczeństwa w celu likwidacji ewentualnego nadciśnienia gazów. W konstrukcji wprowadzono mechanizmy do rekombinacji wodoru i tlenu do postaci wody. Konstrukcja akumulatora umożliwia dyfuzję gazów do elektrod, gdzie następuje reakcja tworzenia wody. Redukuje się również ilość elektrolitu, aby ułatwić transport gazów.
Kolejnym ważnym aspektem związanym z używaniem akumulatorów ołowiowych jest utarta wody w akumulatorze, spowodowana zazwyczaj przez:
- odparowywanie (niewielki procent),
- elektrolizę z wydzielaniem wodoru i tlenu przy rozładowywaniu.
Dodatkowo zanieczyszczenia antymonem, arsenem, kobaltem, manganem, niklem, platyną i tellurem mają bardzo szkodliwy wpływ na pracę akumulatora.
Akumulatory niklowo-kadmowe
Pierwszy patent na alkaiczne baterie drugiego rodzaju zgłosił Szwed, Waldemar Junger. Jego rozwiązanie wykorzystywało wodorotlenek niklu, jako elektrodę dodatnią oraz mieszaninę kadmu i żelaza, jako elektrodę ujemna. Elektrolit to z kolei wodny roztwór wodorotlenku potasu[1].
Akumulatory niklowo-kadmowe posiadają pojemności od 10mAh do 15Ah, przy czym stacjonarne konstrukcje sięgają nawet do 1000Ah – w ich przypadku prąd do startowania urządzeń wynosić musi powyżej 8000A.
Największymi zaletami akumulatorów niklowo-kadmowych są:
- długi czas życia,
- wytrzymałość na przeładowania,
- odporność na duże gęstości prądu,
- prawie stała różnica potencjałów w czasie rozładowywania,
- zdolność od pracy w niskich temperaturach,
- bezobsługowość,
- wielocykliczność.
Z kolei jako wady należy wymienić:
- wysoką cenę kadmu,
- wysoki koszt konstrukcji,
- dużą szkodliwość kadmu.
Rysunek 1.4 przedstawia budowę akumulatora niklowo-kadmowego.
[1] M. Kopczyk, M. Osińska-Broniarz, Akumulator – ekologiczna alternatywa źródła energii dla napędu w systemie transportu, Zeszyty Problemowe – Maszyny Elektryczne 2013, nr 2 (99).
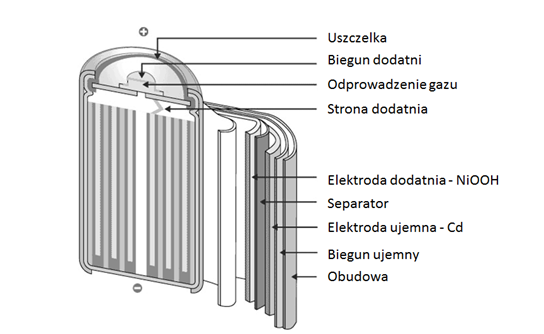
Rys. 1.4. Budowa akumulatora niklowo-kadmowego
Źródło: opracowanie własne.
Akumulatorów Ni-Cd mają zastosowanie w:
- magazynach energii elektrycznej w oświetleniu awaryjnym,
- urządzeniach bezprzewodowych,
- przenośnym sprzęcie RTV,
- sprzęcie AGD (golarki, szczoteczki do zębów, odkurzacze samochodowe itp.).
Akumulatory Ni-Cd stanowią 7% ogólnej liczby sprzedawanych baterii i ponad 80% wszystkich akumulatorów alkaicznych.
Wadą tych akumulatorów jest efekt pamięci, który obliguje użytkowników do całkowitego rozładowania akumulatora przed kolejnym ładowaniem. Akumulatory niklowo-kadmowe należy ładować stałym prądem. Nie mają one ustalonych kryteriów napięciowych dotyczących procesu ładowania, jednak ważne jest ograniczenie prądu ładowania, aby nie dopuścić do ich zniszczenia. Akumulatory Ni-Cd powinny być ładowane prądem o wartości nie przekraczającej 1/10 pojemności akumulatora (np. akumulator o pojemności 1,4 Ah powinien być ładowany prądem 140 mA). Przy takiej wartości prądu czas pełnego ładowania wynosi około 14–16 godzin. W przypadku ciągłego ładowania, prąd ładowania nie powinien przekraczać 1/30 pojemności akumulatora. Najdłuższą żywotność ogniwa Ni-Cd uzyskuje się wtedy, gdy przed rozpoczęciem ładowania zostanie ono całkowicie rozładowane.
Akumulatory niklowo-wodorowe
Ich prawidłowa nazwa to akumulatory niklowo-metalowo-wodorkowe2. Elektrodę dodatnią (anodę) stanowi płytka niklowa, zaś elektrodę ujemną (katodę) stanowi stop metali ziem rzadkich: niklu, manganu, magnezu, aluminium i kobaltu. Separator wykonuje się z poliamidu lub polietylenu. Elektrolitem jest zasadowy związek chemiczny.
Zasada działania opiera się na magazynowaniu gazowego wodoru w stopie metalu, z którego budowana jest elektroda ujemna. O pojemności akumulatora decyduje zdolność pochłaniania wodoru przez stop. Jednak wraz ze wzrostem pojemności następuje zmniejszenie szybkości reakcji fizyko-chemicznej procesu ładowania, co z kolei ogranicza prąd ładowania i rozładowania.
Akumulator Ni-Mh jest następcą opracowanego w latach 60. odwracalnego ogniwa niklowo-wodorowego. Proces elektrochemiczny w obu tych bateriach jest taki sam, różnica zaś polega na metodzie magazynowania wodoru. Jego niezawodność oraz bardzo długi czas życia (przekraczający 7 tys. pełnych cykli ładowania i rozładowania) budziły zainteresowanie. Główny jednak problem sprowadzał się do bezpiecznego gromadzenia wodoru w ogniwie. W nowym rozwiązaniu, zamiast elektrody platynowej, zastosowano taką, która będzie wiązała wodór w swojej strukturze. Dopiero w latach 80. zanotowano pierwsze sukcesy. Po raz pierwszy na rynku akumulator Ni-Mh pojawił się w październiku 1990 roku. Został wprowadzony przez japońską firmę Sanyo Electric. Jego ujemna elektroda wykonana była ze stopu niklu i lantanu i potrafiła zaabsorbować wodór o objętości 1000 razy większej niż jej własna. Dzisiaj elektroda wodorkowa jest znacznie bardziej wyrafinowana, składa się ona z rozmaitych stopów metali ziem rzadkich: niklu, kobaltu, manganu, boru, tytanu, glinu lub wanadu.
Akumulatory Ni-Mh, o takich samych rozmiarach jak akumulatory Ni-Cd, mają dwukrotnie większą pojemność i nie występuje w nich efekt pamięci, a co najważniejsze, nie istnieje potrzeba rozładowywania ich do końca. Czas życia nowoczesnych akumulatorów Ni-Mh nie jest krótszy niż Ni-Cd i osiąga wartość do 1000 cykli. Liczba ta zależna jest oczywiście od warunków ładowania takich jak: prąd, temperatura pokojowa, brak przeładowania.
Wadą ogniw Ni-Mh jest ich duża oporność wewnętrzna oraz bardzo mały poziom prądów chwilowych, przez co nie należy ich stosować do zasilania wiertarek, wkrętaków, kompresorów i innych urządzeń pobierających duży prąd. Poza tym szybszy jest ich czas samorozładowania. Tracą około 25% pojemności w ciągu miesiąca. Akumulator Ni-Mh jest jedynym typem akumulatora nie zawierającym metali ciężkich, dlatego jest znacznie bezpieczniejszy dla środowiska. Akumulatory Ni-MH ładuje się prądem o określonej wielkości. Zazwyczaj zaleca się by ładować je impulsami, gdyż prąd stały może je uszkodzić. By poprawnie naładować akumulatorki Ni-Cd, trzeba zmierzyć temperaturę lub zmienić napięcie na ogniwie. Stosowana jest w tym celu tzw. metoda delta V. Należy zwrócić uwagę na temperaturę wzrastającą w końcowym etapie ładowania. Akumulatory tego typu nie powinny być całkowicie rozładowywane.
Akumulatory sodowo-siarkowe
W akumulatorach sodowo-siarkowych elektrodą ujemną jest sód (Na) zaś elektrodą dodatnią siarka (S). Rolę izolatora pełni tu elektrolit stały (tzw. beta aluminium). Temperatura pracy akumulatorów sodowo-siarkowych sięga około 280°C–360°C. Do największych zalet akumulatorów sodowo-siarkowych należą;
- brak procesu samorozładowania,
- długa żywotność – 15 lat, tzn. około 4 500 cykli,
- możliwość tworzenia dużych systemów,
- łatwość tworzenie połączeń szeregowo-równoległych, ze względu na minimalne różnice wielkości pomiędzy ogniwami.
Rysunek 1.5 przedstawia uproszczoną budową akumulatora sodowo-siarkowego.
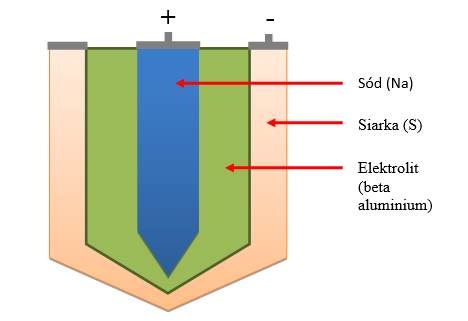
Rys. 1.5. Budowa akumulatorów sodowo-siarkowych
Źródło: opracowanie własne.
Akumulatory sodowo-siarkowe stają się nową alternatywą dla akumulatorów litowo-jonowych. Według amerykańskiego Pacific Northwest National Laboratory (PNNL), rozwój akumulatorów sodowo-siarkowych to najlepszy z możliwych kroków[1], jaki można obecnie wykonać w zakresie rozwoju akumulatorów. Jednak używane obecnie akumulatory sodowo-siarkowe pracują w temperaturach powyżej 300°C, co sprawia, że są mniej wydajne energetycznie i mniej bezpieczne. Dlatego PNNL we współpracy z chińskimi naukowcami z Wuhan University podjęło próbę zbudowania sodowego odpowiednika akumulatorów Li-Ion z tlenkiem manganu. Proste zastąpienie litu sodem nie sprawdziłoby się, gdyż jony sodu są o 70% większe od jonów litu i nie zmieściłyby się w porach katody, dlatego też naukowcy postanowili wykorzystać nanostrukturę zbudowaną z tlenku manganu, która jest w stanie pomieścić jony sodu. W rezultacie powstało coś w rodzaju nanoprzewodów, których ostateczna efektywność silnie zależy od obróbki cieplnej. Najlepsze rezultaty dało potraktowanie nanostruktury temperaturą 750°C, dzięki czemu udało się uzyskać materiał, którego szczytowa pojemność wynosi 128 mAh na gram elektrody, po 100 cyklach ładowania/rozładowania traci jedynie 7% początkowej pojemności, a po 1000 cyklach – 23%.
Akumulatory litowe
W akumulatorach litowych elektrody zbudowane są z porowatego węgiel oraz tlenku metalu. Elektrolit stanowią złożone chemicznie sole litowe rozpuszczone w mieszaninie organicznych rozpuszczalników. Napięcie robocze w akumulatorach litowych wynosi 3,6 V. Do największych zalet akumulatorów litowych można zaliczyć brak efektu pamięci oraz efektu „leniwej baterii”, a także stosunkowo dużą pojemność.
Napięcie w trakcie niemal całego okresu rozładowania akumulatora litowego przekracza napięcie znamionowe 3,6 V. Największymi wadami akumulatorów litowych są:
- możliwości wycieku, zapłonu lub wybuchu, jeśli zostaną nagrzane do wysokich temperatur,
- możliwość zwarcia akumulatora, która może doprowadzić do zapłonu lub eksplozji,
- ryzyko rozgrzania się akumulatora podczas ładowania, co może doprowadzić do wybuchu.
Tabela 1.1 przedstawia porównanie kluczowych parametrów technicznych opisanych akumulatorów.
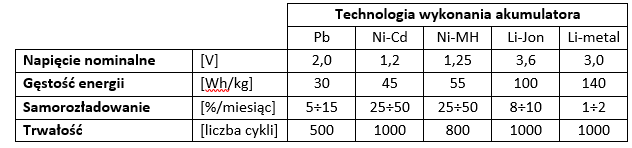
Źródło: Czerwiński A., Akumulatory, baterie, ogniwa., wyd. WKŁ, Warszawa 2005
Ogniwa paliwowe
Historia ogniw paliwowych sięga XIX wieku. Ojcem samej idei ogniw paliwowych był Humphry Bartholomew Davy. Po przeprowadzeniu elektrolizy wody zaproponował, iż (skoro pod wpływem prądu woda rozkłada się na wodór i tlen) synteza tlenu i wodoru powinna powodować produkcję elektryczności. Idea doczekała się realizacji w 1839 roku, gdy William Robert Grove zbudował pierwsze tlenowo-wodorowe ogniwo paliwowe. W 1889 roku udoskonalili je Ludwig Mond i Carl Langer. Dopiero pod koniec II wojny światowej pojawiło się zainteresowanie lekkim, wydajnym, przenośnym i pojemnym źródłem energii elektrycznej – ogniwami paliwowymi. Tabela 4.2 przedstawia typowe reakcje chemiczne zachodzące w ogniwach paliwowych.
Tabela 1.2. Typowe reakcje w ogniwach paliwowych
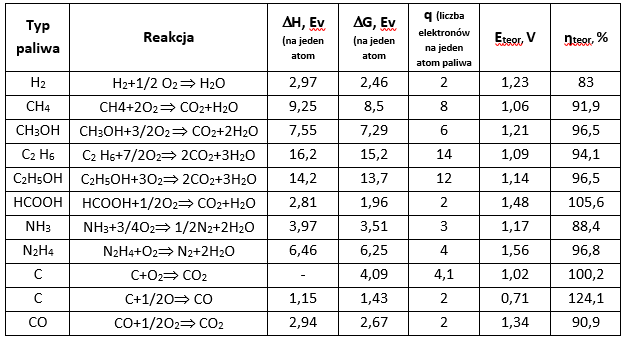
Czerwiński A., Współczesne źródła
Przed konstruktorami ogniw paliwowych stoi wiele trudności związanych zarówno z ich budową, jak i eksploatacją. Napięcie dostarczane przez ogniwa jest mniejsze niż 2V, tak więc aby uzyskać duże moce (duże natężenia prądu), należy zmniejszyć opór elektrolitu, poprzez zwiększenie stężenia lub zmniejszenie dystansu pomiędzy elektrodami. Małe odległości uzyskuje się przy stosowaniu (jako elektrolitu) membran jonowymiennych. Rozwiązaniem tego problemu jest wprowadzenie elektrolitu stałego, ogniwa z elektrolitem PEM (ang. Polymer Electrolyte Membrane lub Proton Exchange Membrane). Membrana taka absorbuje wodę i umożliwia ruch jonów wodoru w temperaturach 0–100oC. Elektrody (rys. 1.6) w ogniwie paliwowym (stykające się przez cienką warstwę katalizatora z membraną) służą do:
- odprowadzania prądu elektrycznego przepływającego przez ogniwo,
- równomiernej dystrybucji gazów do całej czynnej powierzchni membrany,
- odprowadzania wody powstałej na styku anody z membraną.
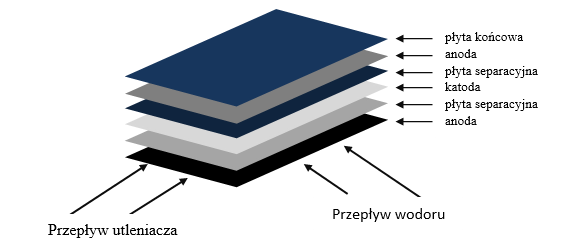
Rys. 1.6. Schemat ideowy ogniwa paliwowego
Źródło: opracowanie własne.
W przypadku ogniw paliwowych, jedynie ogniwo tlenowo-wodorowe (w którym wodór jest paliwem) może pracować w temperaturze poniżej 100°C lub nawet pokojowej. Pozostałe ogniwa są srednio- (100–500oC) i wysokotemperaturowe (500–1500oC). W ogniwie wodorowo-tlenowym zachodzą następujące reakcje:
O2 + 2H2O + 4e Þ 4OH(-) (3)
2H2 + 4OH(-) Þ 2H2O+ 4e(+) (4)
Procesy utleniania w temperaturze pokojowej przebiegają wolno. W związku z tym ogniwa paliwowe pracują w wyższej temperaturze i pod zwiększonym ciśnieniem gazów. Jednym z ważniejszych zagadnień do rozwiązania przy konstruowaniu ogniw paliwowych tlenowo-wodorowych jest sposób otrzymywania i bezpiecznego przechowywania wodoru. Najczęściej dokonuje się go poprzez: przechowywanie wodoru w postaci wodorków lub otrzymywanie wodoru z reformingu węglowodorów np. metanu. Tabela 1.3 przedstawia parametry najpopularniejszych typów ogniw paliwowych.
Tabela 1.3. Przedstawia parametry najpopularniejszych typów ogniw paliwowych
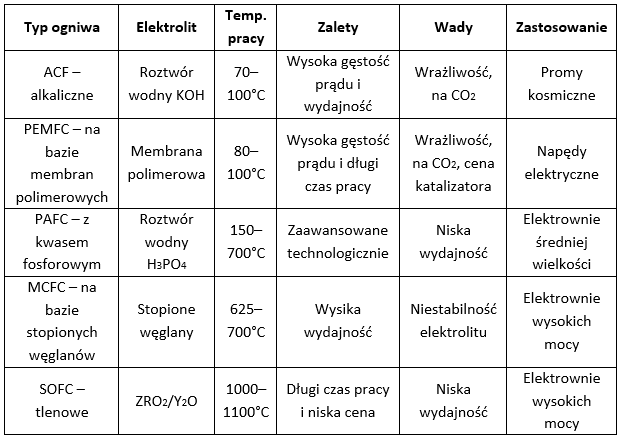
Źródło: opracowanie własne na podstawie Czerwiński A.,
Współczesne źródła energii, wyd. WKŁ, Warszawa 2001.
Elektrownie wodne szczytowo-pompowe
Elektrownie wodne szczytowo-pompowe posiadają dwa zbiorniki wodne dolny i górny. W elektrowniach tych, w godzinach występowania nadmiaru energii w sieci, np. w ciągu nocy, energia jest wykorzystywana do przepompowywania wody ze zbiornika dolnego do górnego. W trakcie dnia, gdy zapotrzebowanie na energię elektryczną rośnie woda z górnego zbiornika napędza turbiny, oddając energię elektryczną do sieci (rys. 1.7).
Największe elektrownie szczytowo-pompowe na świecie to:
- Guri (Wenezuela) – 10,3 GW,
- Ttapi (Brazylia) – 12,6 GW,
- Grand Coulee (USA) – 7,7 GW.
W Polsce funkcjonuje kilka elektrowni szczytowo-pompowych;
- Żarnowiec – 716 MW (największa w Polsce),
- Porąbka-Żar – 500 MW,
- Solina-Myczkowce – 200 MW,
- Żydowo – 167 MW,
- Czorsztyn-Niedzica-Sromowce Wyżne – 94,6 MW,
- Dychów –90 MW.
Elektrownie szczytowo-pompowe idealnie nadają się do roli magazynów ogromnych ilości energii i to w długim czasie. Są w stanie wygładzać krzywą dobowego obciążenia systemu elektroenergetycznego, odbierając moc z systemu w czasie jej nadpodaży i dostarczając w czasie zwiększonego zapotrzebowania. Dzięki niemal płynnemu przejściu z trybu magazynowania na tryb oddawania, elektrownie szczytowo-pompowe, mogą szybko reagować na wahnięcia mocy w systemie, zarówno w postaci nagłych przyrostów, jak i ubytków. Pełną moc osiągają w zaledwie kilka minut. Kolejne cykle rozładowywania/naładowywania nie zmieniają ich pojemności. Samoistny ubytek pojemności, wskutek parowania lub przeciekania wody ze zbiornika górnego jest właściwie pomijalny. Wspomniana wcześniej sprawność na poziomie 65–85% stanowi dobry wynik na tle innych technologii magazynowania energii. Koszty inwestycji w elektrownię szczytowo-pompową są wprawdzie ogromne, jednak przy odpowiedniej różnicy cen energii elektrycznej między szczytem a najniższym poziomem zapotrzebowania na nią, inwestycja ma szansę być rentowna. Budowa elektrowni szczytowo-pompowej to poważne przedsięwzięcie. Musi mieć ono sens ekonomiczny lub uzasadnienie polityczne w zakresie koncepcji bezpieczeństwa energetycznego kraju. Jeżeli chodzi o kwestię modelu biznesowego, elektrownie tego typu bazują na różnicy cen energii pomiędzy szczytem a doliną zapotrzebowania. Zysk z pracy tego typu elektrowni wynika z różnicy między ceną zakupu energii potrzebnej do przepompowania wody ze zbiornika dolnego do górnego a ceną energii sprzedanej do sieci w momencie szczytu energetycznego, kiedy to elektrownia produkuje prąd.
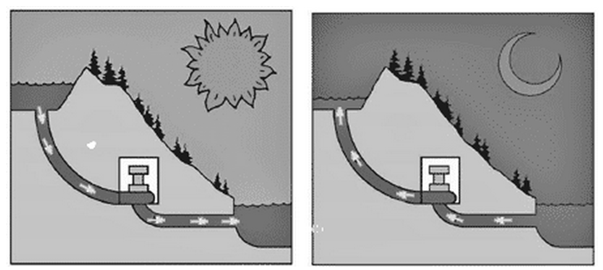
Rys. 1.7. Zasada działania elektrowni szczytowo-pompowych w nocy i w dzień
Źródło: opracowanie własne.
Największą w Polsce elektrownią szczytowo-pompową jest Elektrownia Żarnowiec położona w miejscowości Czymanowo nad Jeziorem Żarnowieckim, w województwie pomorskim. W zamyśle budowy elektrownia miała spełniać rolę akumulatora energii dla powstającej w pobliskim Kartoszynie Elektrowni Jądrowej Żarnowiec. Górny zbiornik wodny elektrowni stanowi zbiornik Czymanowo, sztuczne jezioro o powierzchni 122 ha i pojemności 13 milionów metrów sześciennych. Zbiornik dolny stanowi natomiast Jezioro Żarnowieckie.
Elektrownia wyposażona jest w cztery jednakowe hydrozespoły (rys. 1.8) odwracalne o mocy:
- dla pracy turbinowej – 4 x 179 MW = 716 MW,
- dla pracy pompowej – 4 x 200 MW = 800 MW
Tabela 1.4 przedstawia kubaturę elektrowni Żarnowiec.
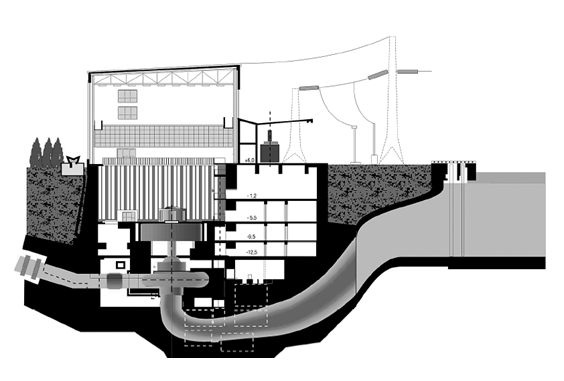
Rys. 1.8. Przekrój poprzeczny przez elektrownie ŻarnowiecJ. Tokarz, L. Hryckiewicz, Elektrownia Wodna Żarnowiec– historia i dzień dzisiejszy, Energetyka i Ekologia 2003.
Tabela 1.4. Kubatura elektrowni Żarnowiec

J. Tokarz, L. Hryckiewicz, Elektrownia Wodna Żarnowiec– historia i dzień dzisiejszy, Energetyka i Ekologia 2003.
Górny zbiornik wody stanowi „akumulator” energii elektrycznej w ilości 3,6GWh. Taka ilość wody pozwala na zasilenie systemu elektroenergetycznego maksymalną mocą przez około 5,5 godziny. Ponowne uzupełnienie wody w zbiorniku górnym wymaga około 6,5 godzin pracy hydrozespołów w ruchu pompowym. Do każdego z czterech hydrozespołów woda jest doprowadzona stalowymi rurociągami ciśnieniowymi o długości ponad 1100 m. Maksymalny przepływ wody czterema rurociągami wynosi 700 m3/s, czyli tyle ile wynosi średni roczny przepływ Wisły w okolicach Warszawy.
Doskonałym sposobem magazynowania energii elektrycznej okazują się przepompownie wody drugiej generacji. Są one przyjazne przyrodzie. W tej zmodyfikowanej technologii problem różnicy wysokości poziomów, między którymi przepływa woda z naziemnych zbiorników w dół poprzez turbinę sprzężoną z elektrogeneratorem, a z powrotem bywa tłoczona pompami, rozwiązano poprzez wykorzystanie wyeksploatowanych wyrobisk zarówno w odkrywkowych kopalniach węgla brunatnego, jak i w głębinowych kopalniach węgla kamiennego. Znany w świecie koncern energetyczny RWE Power AG zaangażował się w budowę tego typu szczytowych wodnych elektrowni. Jedną z nich zbudował wspólnie z koncernem Societe Electrique de J’Our w luksemburskiej miejscowości Vianden. Jako dolny zasobnik wody wykorzystuje ona wyeksploatowaną kopalnię węgla kamiennego i posiada turbinę sprzężoną z elektrogeneratorem o mocy 1096 MW. W Polsce przed dwudziestoma laty zalano wodą kopalnie węgla kamiennego w okręgu wałbrzyskim i ubolewać należy nad faktem, że dotychczas nie rozważono ich ewentualnego wykorzystania dla zainstalowania (na ich terenie) szczytowej wodnej elektrowni.
Górny zbiornik wody stanowi „akumulator” energii elektrycznej w ilości 3,6GWh. Taka ilość wody pozwala na zasilenie systemu elektroenergetycznego maksymalną mocą przez około 5,5 godziny. Ponowne uzupełnienie wody w zbiorniku górnym wymaga około 6,5 godzin pracy hydrozespołów w ruchu pompowym. Do każdego z czterech hydrozespołów woda jest doprowadzona stalowymi rurociągami ciśnieniowymi o długości ponad 1100 m. Maksymalny przepływ wody czterema rurociągami wynosi 700 m3/s, czyli tyle ile wynosi średni roczny przepływ Wisły w okolicach Warszawy.
Magazynowanie sprężonego powietrza
Magazynowanie powietrza sprężonego do ciśnienia około 70 atmosfer jest kolejnym ze sposobów magazynowania energii. W tego typu elektrowniach generator zasilany jest paliwem ciekłym lub gazowym. W grudniu 1978 roku magazyn CAES (rys. 1.9) na 290 MW w Huntorf w Nimczech rozpoczął działalność komercyjną [1]. Dla potrzeb obecnego właściciela, firmy E. ON Kraftwerke, magazyn Huntorf przechowuje sprężone powietrze w dwóch jaskiniach po opróżnionych złożach soli o łącznej pojemności 310 000 m³, leżących około 650 m pod ziemią. Magazyn współpracuje z elektrowniami wiatrowymi (rys. 1.10).
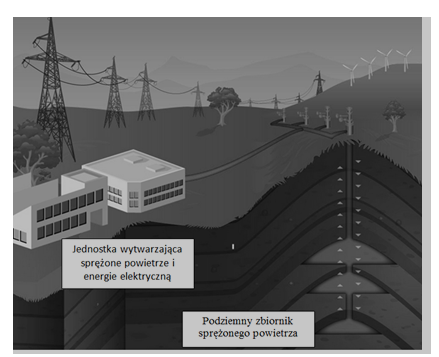
Rysunek 1.9. Magazyn energii CAESH. Lund, G. Salgi, The role of compressed air energy storage (CAES) in future sustainable energy systems, Energy Conversion and Management May 2009, Vol. 50, Issue 5, ,s. 1172–1179.
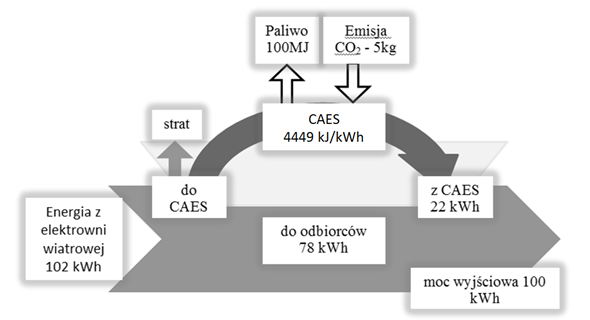
Rys. 1.10. Schemat obiegu energii w elektrowni hybrydowej z wykorzystaniem CAES
Źródło: opracowanie własne na podstawie H. Lund, G. Salgi, The role of compressed air energy storage (CAES) in future sustainable energy systems, Energy Conversion and Management May 2009, Vol. 50, Issue 5, ,s. 1172–1179.
Superkondensatory – kondensatory elektrochemiczne
Superkondensatory zbudowane są z dwóch elektrod oddzielonych elektrolitem. Obie elektrody wykonane są z tego samego materiału. Posiadają one zdolność gromadzenia bardzo dużych ładunków elektrycznych w krótkim czasie i w równie krótkim czasie są w stanie tę energię oddać. Różnica pomiędzy superkondensatorami a ogniwami galwanicznymi dotyczy charakteru użytych materiałów elektrodowych i mechanizmu gromadzenia ładunku. Jak już wspomniano, dla kondensatorów elektrochemicznych najczęściej obie elektrody wykonane są z tego samego materiału, zaś w ogniwach galwanicznych elektrody różnią się pod względem chemicznym (materiał anodowy jest inny niż materiał katodowy). Schemat superkondensatora przedstawia rysunek 1.11.
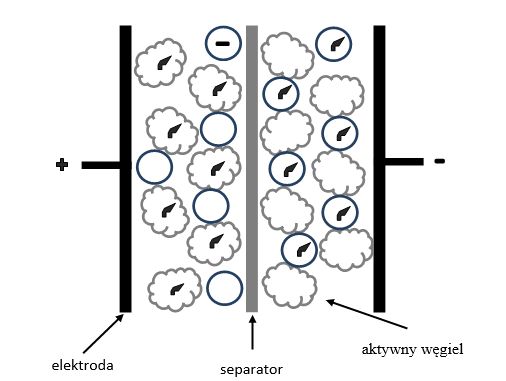
Rys. 4.11. Schemat superkondensatora
Źródło: opracowanie własne.
Akumulatory kinetyczne
Akumulatory kinetyczne działają podobnie do koła zamachowego. Najważniejszym elementem jest wirnik, zwany bezwładnikiem, który umożliwia magazynowanie energii
w formie wirującej masy. Aby prędkości osiągane przez bezwładnik były wystarczająco duże, wymagane jest bardzo dobre łożyskowanie oraz zmniejszenie oporów aerodynamicznych przez umieszczenie w obudowie gazu o małej gęstości (np. wodór, argon lub silnie rozrzedzone powietrze). Zapewnia to również redukcję strat energii. W przeciwieństwie do akumulatorów chemicznych, akumulatory kinetyczne odporne są na wahania temperatur oraz pozbawione efektu pamięci. Akumulatory kinetyczne nie sprawdzają się w przypadku długotrwałego magazynowania energii. Dotychczas znalazły wąskie zastosowanie w przemyśle samochodowym. Gęstość magazynowania energii wynosi od 100 do 300 kJ na kg.
Nadprzewodnikowe zasobniki energii (SMES)
Nadprzewodnikowe zasobniki energii są obok baterii kondensatorów systemem bezpośredniego magazynowania energii elektrycznej na dużą skalę. Energia elektryczna jest magazynowana w polu magnetycznym cewki o indukcyjności L. Pole zostaje wzbudzone pod wpływem przepływu prądu elektrycznego przez uzwojenia cewki. Po obniżeniu temperatury w pobliże zera absolutnego (przy temperaturze około 4K) uzyskuje się stan nadprzewodnictwa, w którym oporność metalu praktycznie zanika. W tym stanie niewielkie napięcie wzbudza wielki prąd i magnes staje się magazynem energii elektrycznej o dużej pojemności. Do najważniejszych właściwości zasobników energii SMES należą:
- moc nominalna od 10 do 100 MW,
- sprawność od 90 do 95%,
- czas rozładowania od sekundy do minuty,
- czas eksploatacji – 30 lat.
Porównanie metod magazynowania energii
Jak wynika z opisu poszczególnych metod magazynowania energii, jedne z nich nadają się do większych zespołów energetycznych (elektrownia szczytowo-pompowa, CAES), inne do małych jednostek wytwórczych (baterie akumulatorów żelowych), natomiast niektóre metody pozwalają jedynie na redukcje krótkotrwałych niedoborów energii (superkondensatory, akumulator kinetyczny). W tabeli 1.5 przedstawiono porównanie niektórych z tych technologii.
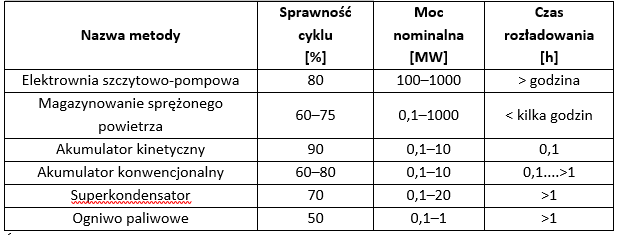
Źródło: opracowanie własne na podstawie Kwiatkowski M., Wykorzystywanie technologii magazynowania energii w postaci sprężonego powietrza w ramach integracji farm wiatrowych z systemem elektroenergetycznym, Zeszyty Naukowe Instytutu Gospodarki Surowcami Mineralnymi i Energi Polskiej Akademii Nauk nr 78, 2010
W tabeli 1.6 pokazano porównanie kosztów tych metod magazynowania energii.
Tabela 1.6. Porównanie kosztów

Źródło: opracowanie własne na podstawie Kwiatkowski M., Wykorzystywanie technologii magazynowania energii w postaci sprężonego powietrza w ramach integracji farm wiatrowych z systemem elektroenergetycznym, Zeszyty Naukowe Instytutu Gospodarki Surowcami Mineralnymi i Energi Polskiej Akademii Nauk nr 78, 201
Rysunek 1.12 obrazuje porównanie rozkładu typowych mocy i możliwości magazynowania energii elektrycznej przy wykorzystaniu niektórych omówionych technologii.
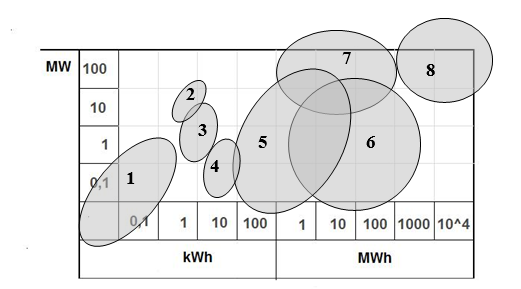
1 – Superkondensatory; 2 – Zwoje nadprzewodzące; 3 – Koła zamachowe; 4 – Systemy sprężonego powietrza powierzchniowe; 5 – Akumulatory konwencjonalne;
6 – Akumulatory elektrochemiczne i ogniwa paliwowe; 7 – Systemy magazynowania sprężonego powietrza; 8 – elektrownie szczytowo-pompowe
Rys. 1.12. Rozkład typowych mocy i możliwości magazynowania energii elektrycznej przy wykorzystaniu niektórych technologii Herlender K., Wykorzystanie akumulatorów w systemach magazynowania energii, ENERGETAB 2013 Bielsko-Biała 17.09.2013 r.
Literatura:
- Hubkowska K., Łukaszewski M., Koss U., Czerwiński A., Characterization and electrochemical behavior of Pd-rich Pd-Ru alloys, Electrochimica Acta 2014, 132, s. 214–222.
- Hubkowska K., Łukaszewski M., Czerwiński A., Thermodynamics of hydride formation and decomposition in electrodeposited Pd-rich Pd-Ru alloys, Electrochimistry Communications, 2014, 48, s. 40–43
- Lund H., Salgi G., The role of compressed air energy storage (CAES) in future sustainable energy systems, Energy Conversion and Management May 2009, Vol. 50, Issue 5, s. 1172–
- Czerwiński A., Akumulatory, baterie, ogniwa., WKŁ, Warszawa 2005.
- Czerwiński A., Współczesne źródła energii, WKŁ, Warszawa 2001.
- Kopczyk M., Rozwój akumulatorów w pojazdach transportu miejskiego – znaczenie dla środowiska, Ogólnopolska Konferencja Szkoleniowa „Transport miejski a ochrona środowiska” 17–18.11.2008 (materiały konferencyjne).
- Kopczyk M., Osińska-Broniarz M., Akumulator – ekologiczna alternatywa źródła energii dla napędu w systemie transportu, Zeszyty Problemowe – Maszyny Elektryczne 2013, nr 2 (99).
- electronicsweekly.com/news/research/materials-rd/nano-engineering-unlocks-sodium-ion-batteries-2011-06
- Tokarz J., Hryckiewicz L., Elektrownia Wodna Żarnowiec – historia i dzień dzisiejszy, Energetyka i Ekologia 2003.
- Kwiatkowski M., Wykorzystywanie technologii magazynowania energii w postaci sprężonego powietrza w ramach integracji farm wiatrowych z systemem elektroenergetycznym, Zeszyty Naukowe Instytutu Gospodarki Surowcami Mineralnymi i Energii Polskiej Akademii Nauk nr 78, 2010.
- Herlender K., Wykorzystanie akumulatorów w systemach magazynowania energii, ENERGETAB 2013, Bielsko-Biała 17.09.2013.
[1] H. Lund, G. Salgi, The role of compressed air energy storage (CAES) in future sustainable energy systems, Energy Conversion and Management May 2009, Vol. 50, Issue 5, ,s. 1172–1179.









